ساختار باتری:
به طور ساده می توان باتری را سلول یا یک پَک شیمیایی (chemical power pack) تعریف کرد که در مواقع نیاز، می تواند انرژی شیمیایی را به به انرژی الکتریکی تبدیل کند.

یک باتری با انجام واکنش هایی شیمیایی درون خود، انرژی شیمیایی موجود را به انرژی الکتریکی تبدیل می کند. باتری بسته به مشخصات ساختاری و نوع استفاده از آن، می تواند عمری بین چند ساعت تا چند هفته داشته باشد.
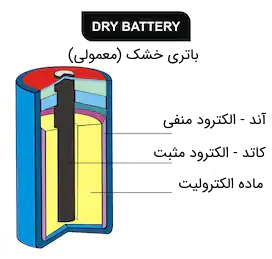
قسمت اصلی یک باتری که انرژی الکتریکی لازم را فراهم می کند، سلول (Cell) نام دارد. سلول باتری از 3 جزء (دو الکترود و یک ماده شیمیایی به نام الکترولیت) تشکیل شده است.
جهت ایزوله کردن سلول از محیط بیرون و همچنین فراهم کردن ایمنی و راحتی استفاده، سلول درون یک بسته یا کِیس (case) خارجی (فلز یا پلاستیکی) قرار دارد.
در این بسته خارجی دو الکترود با علامت های + (قطب مثبت) و - (قطب منفی) وجود دارد که به دو الکترود داخلی سلول متصل هستند.
می توان گفت که تفاوت یک باتری با سلول در این است که یک باتری می تواند از یک یا چندین سلول تشکیل شده باشد که بدین ترتیب ظرفیت و قدرت آن ها به یکدیگر اضافه می شود. در این رابط، احتمالاً واژه باتری 6 یا 8 سلولی لپ تاپ به گوشتان آشنا است.

هنگامی که دو الکترود باتری به یک مدار، به طور مثال یک لامپ ساده، متصل شوند، ماده شیمیایی درون سلول (الکترولیت) شروع به فعالیت می کند.
در واقع این مواد طی واکنش هایی شیمیایی به آرامی به مواد دیگری تبدیل می شوند. می توان گفت که طی واکنش های شیمیایی خاصی که در الکترولیت اتفاق می افتد، یون هایی تشکیل و الکترون هایی آزاد می شوند.
الکترون های آزاد شده می توانند از سر قطب منفی در مدار شارش کرده و انرژی الکتریکی مورد نیاز مدار را تامین کنند.
این روند تا زمانی که ماده الکترولیت به طور کامل دگرگون شود (به ماده دیگری تبدیل شود) ادامه پیدا می کند. در این صورت، حرکت یون ها در الکترولیت و شارش الکترون ها در مدار متوقف می شود.
چرا باتری ها به دو ماده مختلف نیاز دارند؟
اگر دقت کرده باشید، دو الکترود باتری از دو ماده متفاوت ساخته شده اند. در واقع رسانایی الکتریکی این دو ماده با یکدیگر متفاوت است.
یکی از الکترود ها تمایل به جذب الکترون ها داشته و دیگری به راحتی الکترون ها را عبور می دهد. بدیهی است که اگر هر دو الکترود جنس یکسانی داشتند، هیچ جریانی شارش پیدا نمی کرد.
برای اینکه درک بهتری از این موضوع داشته باشیم، اجازه دهید نگاهی به تاریخچه الکتریسیته در سال 1792 میلادی داشته باشیم. در آن زمان «لوئیچی گالوانی» (Luigi Galvani) دریافت که می تواند به کمک پای قورباغه، الکتریسیته تولید کند.
گالوانی با اتصال (وارد کردن) دو الکترود به دو پای قورباغه مرده، توانست جریان الکتریسیته تولید کند. وی نام این الکتریسیته را برق حیوانات (animal electricity) نامید.
اندکی بعد دانشمند هم وطنش «الکساندر ولتا» (Alessandro Volta) دریافت که دو الکترود استفاده شده توسط گاوانی، جنس های متفاوتی دارند. در اینجا بدن قورباغه حکم ماده الکترولیت را بین دو الکترود با جنس مختلف دارد.
با گذشت زمان مشخص شد که هیچ چیز خاص و عجیبی در بدن قورباغه وجود نداشته و یک ماده شیمیایی مناسب و یا حتی یک لیمو می تواند به عنوان ماده الکترولیت استفاده شود.
اما از نقطه نظر علم شیمی چه چیزی باعث تفاوت در عملکرد الکترود ها می شود؟ شاید از دوران دبیرستان با ویژگی الکترونگاتیوی آشنا باشید.
الکترونگاتیوی پارامتری برای سنجش الکترون خواهی عناصر شیمیایی است. در واقع هرچه یک عنصر الکترونگاتیوتر باشد، تمایل آن برای جذب الکترون بیشتر است.
با اتصال دو فلز مختلف به ماده ای الکترولیت و قرار دادن آن در یک مدار الکتریکی، شاهد شارش الکترون ها (برقراری جریان الکتریکی) هستیم.
در واقع یکی از فلزات که الکترونگاتیوتر است، تمایل به گرفتن الکترون های فلز دیگر دارد. با این اوصاف اگر دو فلز، جنس یکسانی داشته باشند، هیچگونه جریانی در مدار برقرار نمی شود.















